химия
Законите на стехиометрията описват състава на различните вещества, въз основа на връзките (в масата) между всеки вид, който се намесва в реакцията. Цялата съществуваща материя се формира от комбинацията, в различни пропорции, на различните химически елементи, които съставят периодичната таблица. Тези съюзи се управляват от определени закони на комбинация, известни като "закони на стехиометрията" или "закони за тежестта на химията". Тези принципи са съществена част от количествената химия, които са от съществено значен
Етанамидът е химично вещество, което принадлежи към групата на органичните азотни съединения. Той също така получава името ацетамид, според Международния съюз за чиста и приложна химия (IUPAC за акронима на английски език). Търговски се нарича амид на оцетна киселина. Той се нарича амид, защото азотът е свързан с карбонилна група. Той е първичен, тъй като запазва двата водородни атома, свързани с азо
Реакцията на Maillard е името, дадено на химични реакции между аминокиселини и редуциращи захари, които замъгляват храната по време на печене, печене, печене и пържене. Кафявите съединения са отговорни за цвета и аромата на продукти като хляб от кора, печено говеждо месо, пържени картофи и печени бисквити. Реакцията се благоприятства от топлината (температури между 140 до 165 ° С), въпреки че също се осъществява при по-ниска скорост, при стайна температура. Френският лекар и химик Луи-Камил Маярд го описва през 1912 година. Потъмняването настъпв
Алуминиев хлорид или алуминиев трихлорид (А1С1з) е бинарна сол, образувана от алуминий и хлор. Понякога се появява като жълт прах, защото има примеси, дължащи се на наличието на железен (III) хлорид. Тя се получава чрез комбиниране на нейните елементи. Алуминият, който има три електрона в своето последно енергийно ниво (семейство IIIA), се стреми да г
Карбоксилната киселина е термин, който се приписва на всяко органично съединение, което съдържа карбоксилна група. Те могат също да бъдат наричани органични киселини и присъстват в много природни източници. Например, мравчена киселина, карбоксилна киселина, се дестилира от мравки и други насекоми, като например жълтата галерита. Това означава, че мравунякът е богат източник на
Алендроновата киселина е органично съединение, което принадлежи към класификацията на бифосфонати, по-специално тези от второто поколение; Това са тези, които съдържат азотни атоми. Това съединение, както и останалите бисфосфонати, има висока структурна аналогия с неорганичния пирофосфат (PPi). Неорганичният пирофосфат е продукт на
Мравчена киселина или метанолова киселина Това е най-простото и най-малко съединение от всички органични киселини. Известна е също като метанолова киселина и нейната молекулна формула е НСООН, имаща само един водороден атом, свързан с въглеродния атом. Името му произлиза от думата formica , която на латински означава ant. Натуралистите от 15-ти век установиха, че някои видове насекоми (formicidae), като мравки, термити, пчели и бръмбари, отделят това съедине
Винената киселина е органично съединение, чиято молекулна формула е СООН (СНОН) 2СООН. Той има две карбоксилни групи; това означава, че може да освободи два протона (H +). С други думи, това е дипротична киселина. Също така, той може да се класифицира като алдеринова киселина (кисела захар) и производн
Калциев хлорид (CaCl2 ) Той е неорганична сол, съставена от калциев, алкалоземен метал и хлорен халоген. В това съединение има няколко електростатични взаимодействия, които определят външния вид на неговите кристали и останалите физически свойства. Също така, тя винаги е придружена от водни молекули, образуващи хидрати с общи формули CaCl 2 · xH 2 O, с х = 0, 1, 2, 4 и 6. Когато х = 0, солта няма вода и е безводна, като посочва химическата формул
Екзотермичната реакция е вид химическа реакция, при която се осъществява пренос на енергия, главно под формата на отделяне на топлина или светлина. Името идва от гръцката префикс exo , което означава "навън"; и терминът "термичен", който се отнася до топлина или температура. В този смисъл, екзотермичните реакции могат да пренесат други видове енергия в средата, в която се генерират, като например с експлозии и техния начин на предаване на кинетична и звукова енергия, когато вещества, които
Химичните разтвори са известни като хомогенни смеси в химията. Те са стабилни смеси от две или повече вещества, в които едно вещество (наречено разтворимо вещество) се разтваря в друго (наречено разтворител). Разтворите приемат фазата на разтворителя в сместа и могат да съществуват в твърда, течна и газообразна фаза. В природата съществуват два вида смеси: хетерогенни смеси и
Пиролизата се състои от процес на термично разлагане, където веществата с органичен произход в голяма част от него са подложени на високи температури в инертна среда (без присъствието на кислород). Когато органичната материя се обработва чрез пиролиза, се получават продукти, които се използват в промишлената област. Един от елементите, които могат да бъдат п
Термохимията отговаря за изследването на калоричните модификации, които се извършват в реакциите между два или повече вида. Счита се за съществена част от термодинамиката, която изучава трансформацията на топлината и другите видове енергия, за да разбере посоката, в която се развиват процесите и как тяхната енергия варира. Също така е важно да се разбере, че топлината включва пренос на топлинна енергия, която се случва между две тела, когато те са при различни температури; докато топлинната енергия е тази, която е свързана със случайното движение, което притежават атомите и молекулите. За
Калиев нитрат е трикомпонентна сол, съставена от калий, алкален метал и оксоанион нитрат. Химичната му формула е KNO 3 , което означава, че за всеки K + йон има йон на NO 3 - взаимодействащ с него. Следователно тя е йонна сол и представлява един от алкалните нитрати (LiNO 3 , NaNO 3 , RbNO 3 ...). KNO3 е силно окислително средство поради н
Дифениламинът е органично съединение, чиято химична формула е (C6H5) 2NH. Името му показва, че е амин, както и неговата формула (-NH2). От друга страна, терминът "дифенил" се отнася до присъствието на два ароматни пръстена, свързани с азот. Съответно, дифениламинът е ароматен амин. В света на органичните съединения думата aromatic не е непременно свързана със съществуването на неговите миризми, а с характеристики,
Стронциевият хлорид е неорганично съединение, образувано от стронций, алкалоземен метал (г-н Becamgbara) и халогенен хлор. Тъй като и двата елемента имат много различни електронегативности, съединението е йонно твърдо вещество, чиято химична формула е SrCl 2 . Тъй като е йонно твърдо тяло, то се състои от йони. За случая на SrCl 2 те са Sr2 + катион за всеки два Cl-аниона. Неговите свойства и приложения са подобни на калциевите и бариевите хлориди, с тази
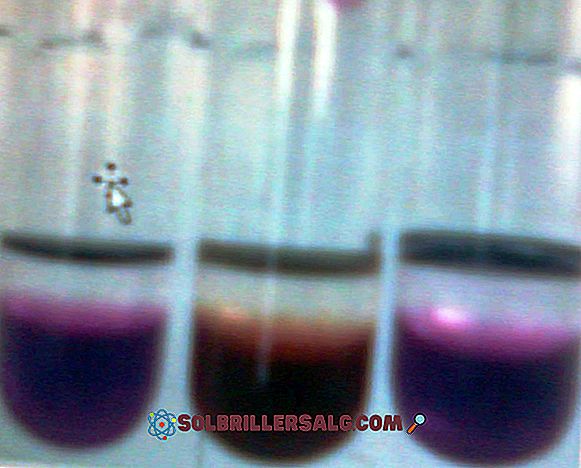
Фенолфталеин е органично багрило, което от своя страна е слаба дипротична киселина, използвана при много обемни определяния като киселинно-основен индикатор. Тоест, ако е дипротична киселина, в разтвора тя може да загуби два H + йона и за да бъде индикатор, тя трябва да притежава свойството да бъде цветно в обхвата на рН, който се оценява. В основната среда (рН> 8) фенолфталеинът е розов, който може да се засили до пурпурно червено (както е показано на следното изображение). За да бъде използван като киселинно-основен индикатор, той не трябва да реагира по-бързо с ОН- на средата, отколкото а
Калиев перманганат ( KMnO 4) е неорганично съединение, образувано от групата на манган - преходни метали 7 (VIIB), кислород и калий. Това е тъмно пурпурно твърдо тяло. Водните им разтвори също са тъмно пурпурни; Тези разтвори стават по-малко виолетови, тъй като се разреждат в по-големи количества вода. След това KMnO 4 започва да претърпява редукции (увеличаване на електроните) в последователност от цветове в следния ред: пурпурен> син> зелен> жълт> безцветен (с кафява утайка от MnO 2 ). Тази реакция показва важно сво
Стронциевият оксид , чиято химична формула е SrO (да не се бърка със стронциевия пероксид, който е SrO2), е продукт на окислителната реакция между този метал и присъстващия във въздуха кислород при стайна температура: 2Sr (s) + O2 (g) → 2SrO (s). Парче стронций изгаря в контакт с въздуха като следствие от високата му реактивност и тъй като има електронна конфигурация от типа ns2, той лесно дава своите два валентни
Диференциалният или диференциращ електрон е последният електрон, поставен в последователността на електронната конфигурация на атома. Защо се казва името му? За да се отговори на този въпрос, е необходима основната структура на атома: неговото ядро, вакуум и електрони. Ядрото е плътен, компактен агрегат от положителни частици, наречени протони, и неутрални частици, наречени неутрони. Протоните дефинират атомния номер Z и заедно с неутроните съставляват атомната маса. Обаче един атом не мо
Хидроксиапатитът е калциев фосфатен минерал, чиято химична формула е Ca 10 (PO 4 ) 6 (OH) 2 . Заедно с други минерали и органична материя остава смачкан и уплътнен, той образува суровината, известна като фосфорна скала. Терминът "хидрокси" се отнася до ОН-анион. Ако вместо този анион е флуорид, минералът ще се нарича флуорапатит (Ca 10 (PO 4 ) 6 (F) 2 , и така с други а
Магнезиевият фосфат е термин, използван за означаване на семейство неорганични съединения, образувани от магнезий, алкалоземен метал и оксоанион фосфат. Най-простият магнезиев фосфат има химична формула Mg 3 (PO 4 ) 2 . Формулата показва, че за всеки два аниона PO 4 3 има три катиона Mg2 +, взаимодействащи с тях. Също така, тези съединения могат да бъдат описани като магнезиеви соли, полу
Стъклото Pyrex е специално боросиликатно стъкло, чиято марка (Pyrex) се появява в град Ню Йорк през 1915 г., произведена от Corning Glass. Тя се появи като материал за модерни опаковки за храни, използван също за съхранение и печене на храна в същия вид контейнер. Произходът на думата „пирекс“ е породил известни несъответствия, но се приема, че той произлиза от най-продаваната статия в началните моменти на неговата комерсиализация: плоча, в която
Енантиомери са онези двойки органични (и неорганични) съединения, които се състоят от две огледални образи, които не могат да се припокриват една с друга. Когато настъпи обратното - например в случай на топка, голф клуб или вилица - те се наричат ахирални обекти. Терминът хиралност е измислен от Уилям Томсън (лорд Келвин), който определя, че обектът е хирален, ако не може да се припокрива с неговия огледален образ. Например, ръцете са хирални елементи, защото отражението на
Цветните метали са тези, които нямат или имат незначителни количества желязо. Те, в различни масови пропорции, се използват за създаването на сплави, които показват по-добри физични свойства от отделните метали. По този начин неговите кристални структури и метални взаимодействия са в основата на приложенията на цветни сплави. Тези чисти метали обаче намират по-малко приложения, защо
Утаяването или химичното утаяване е процес, който се състои в образуването на неразтворимо твърдо вещество от сместа от два хомогенни разтвора. За разлика от валежите от дъжд и сняг, при този вид валежи "вали твърдо" от повърхността на течността. В два хомогенни разтвора йони се разтварят във вода. Когато те взаимодействат с други йони (по време на смесването), техните електростатични взаимодействия позволяват растежа на кристал или на желатин
Металният характер на елементите на периодичната таблица се отнася за всички тези променливи, химически и физически, които определят металите или ги отличават от други природни вещества. Те са обикновено ярки, плътни, твърди твърди частици, с висока термична и електрическа проводимост, формовани и пластични. Въпреки това, не всички метали им
Диазониевите соли са органични съединения, в които има йонни взаимодействия между азогрупата (-N2 +) и анион X- (Cl-, F-, CH3COO- и т.н.). Неговата обща химична формула е RN2 + X- и в това страничната верига R може да бъде или алифатна група или арилова група; това е ароматен пръстен. Структурата на анодиазониевия йон е представена в долното изображение. Сините сфери съответстват на азогрупата, докато черните и белите сфери съставляват ароматния пръстен на фениловата група. Азо г
Черните метали са тези, които съдържат желязо (Fe), както и малки количества други метали, които се добавят, за да дадат определени полезни свойства на техните сплави. Въпреки че желязото може да съществува в различни окислителни състояния, най-често се срещат +2 (железни) и +3 (железни). Обаче терминът "железен" се отнася до присъствието на желязо, независимо от неговото окислително състояние в материала. Желязото е четвъртият най-разпространен елемент в земната кора, но в световен мащаб той е осно
Бандовата теория е тази, която определя електронната структура на твърдото тяло като цяло. Тя може да се прилага за всякакъв вид твърдо вещество, но тя е в металите, където се отразяват най-големите му успехи. Според тази теория, металната връзка е резултат от електростатичното привличане между положително заредените йони и подвижните електрони в кристала. Следователно, метал