5 Фактори, които влияят на скоростта на реакцията
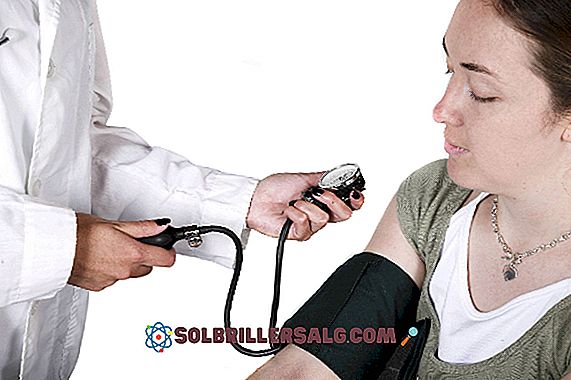
Скоростта на химическата реакция е скоростта, при която трансформацията на вещества, наречени реагенти, се среща в други вещества, наречени продукти. Факторите, които влияят на скоростта, могат да бъдат няколко; естество на реагентите, размер на частиците, физично състояние на веществата ...
Реагентите могат да бъдат атоми или молекули, които се сблъскват или се сблъскват помежду си, причинявайки прекъсване на връзките между тях. След почивката се създават нови връзки и се формират продуктите.

Ако поне един от реактивите е напълно изразходван в реакцията, образувайки продукта изцяло, реакцията се казва, че е пълна и насочена само в една посока.
В някои случаи образуваните продукти отново се сблъскват и прекъсват връзките си, за да се реорганизират и отново да станат реагенти. Това се нарича обратна реакция.
И двете реакции протичат при различни скорости, но когато скоростта на директната реакция е равна на скоростта на обратната реакция, се установява кинетично равновесие, което означава, че реакцията е в равновесие.
Фактори, които влияят на скоростта на реакцията
Всяка химическа реакция е подложена на редица фактори, които водят до бързо или бавно преминаване на скоростта. Откриваме реакции, които се случват за секунди, като експлозии, и други, които отнемат малко повече време, като окисляването на желязна пръчка, отворена на открито.
Тези фактори, които влияят на скоростта на химическа реакция, са:
Размер на частиците на веществата
Той е известен също като контактна повърхност. Ако веществата имат голяма контактна повърхност, т.е. те са много компактни, реакцията е по-бавна, отколкото когато контактната повърхност е малка.
Пример за това е реакцията на Alka seltzer в таблетки и Alka seltzer в прах. Alka seltzer е смес от ацетилсалицилова киселина, с натриев бикарбонат, калциев фосфат и лимонена киселина.

Ако веществата са атомни видове, те също имат вариация в тяхната реактивност поради размера на атома и броя на електроните в последното им ниво.
Поради това, натрий (Na) реагира бурно с вода в сравнение с калций (Са). По същия начин, желязото (Fe) лесно се окислява чрез действието на водни пари, присъстващи в околния въздух, в сравнение с оловото (Pb), чиято реакция е много по-бавна.
Йонните видове имат много висока реактивност (ниски скорости на реакция), в сравнение с неутралните им видове. Следователно, Mg + 2 е по-реактивоспособен от Mg.
Физическо състояние на веществата
Състоянието на агрегация на реагентите също влияе върху скоростта на реакцията. В твърдото състояние частиците (атомите) са много близки, така че мобилността между тях е много малка, с много бавни сблъсъци.
В течното състояние частиците имат по-голяма подвижност, което прави реакциите по-бързи в сравнение с твърдото състояние.
В газовото състояние реакцията има много по-висока скорост, благодарение на голямото разделяне между частиците на реагентите.
За да се увеличи скоростта на реакция на дадено вещество, тя може да се разтвори във вода по такъв начин, че молекулите да бъдат разтворени и мобилността между тях да се увеличи.
Концентрация на реактивите
Концентрацията на дадено вещество се отнася до количеството частици (атоми, йони или молекули), които са в даден обем.
При химична реакция, ако има много частици, броят на сблъсъците между тях ще бъде много висок, така че скоростта на реакцията ще бъде висока.
Колкото по-висока е концентрацията на реагентите, толкова по-голяма ще бъде скоростта на реакцията на образуване на продуктите.
температура
В система, съставена от реагенти, всички частици, които я правят, са в движение, или вибриращи, както се случва при твърди вещества, или се движат в случай на течности и газове.
И в двата случая се наблюдават вибрационни Е и Е кинетични съответно. Тези енергии са пряко пропорционални на температурата, при която се намира системата.
Чрез повишаване на температурата на системата се повишават молекулярните движения на веществата.
Сблъсъците между тях стават все по-силни, за да се получи счупване и свързване, преодолявайки препятствието, което представлява енергията на активиране Ea.
При повишаване на температурата на системата, реактивността се увеличава и скоростта на реакцията е по-малка, следователно, по-бърза.
катализатори
Това са химични вещества, които влияят на химическа реакция, или чрез увеличаване на скоростта на реакцията, или чрез намаляване на реакцията. Нейната основна характеристика е, че тя не участва в химичната реакция, което означава, че в края на реакцията, тя може да бъде изолирана от системата.
Пример за това е хидрогенирането на органично съединение, ненаситено с литиево алуминиев хидрид като катализатор:
СН3-СН = СН-СН3 + Н2СН3-С2-СН2-СН3
В химическо уравнение катализаторът се поставя върху стрелката, която показва посоката на реакцията.
При химична реакция може да се случи, че и катализаторът и реагентите не са в едно и също физическо състояние, този тип система е известна като "хетерогенна".
Те се наричат контактни катализатори. "Хомогенните" катализатори са тези, които имат едно и също физическо състояние на реагентите и се наричат транспортиране.