Каква е теорията на сблъсъците? Основни характеристики
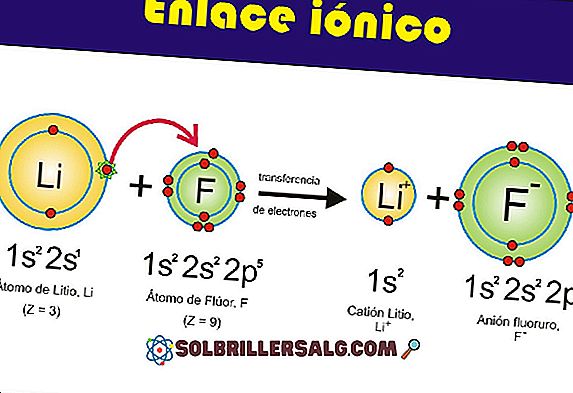
Теорията на сблъсъците разкрива принципа на че всяка химическа реакция се получава благодарение на молекулите, атомите или йоните на реагентите, които се сблъскват помежду си.
Сблъсъкът между видовете не винаги ще бъде същият. Това ще зависи от концентрацията и вида на реагента, с който работите.

Доколкото концентрацията на реагентите се увеличава, броят на шоковете се увеличава. Обратното ще се случи, ако концентрацията намалее.
Това се дължи на факта, че колкото по-висока е концентрацията на реагентите, толкова по-голям е броят на атомите и по-големи са сблъсъците между тях.
Въпреки това, не всички сблъсъци са ефективни и затова не всички молекули, които реагират, ще генерират продукти.
Ако това беше така, всички реакции между течности или разтворени вещества биха били изключително бързи, тъй като в тези състояния има по-голям сблъсък между молекулите.
В реалния живот има няколко реакции, които са склонни да се формират при високи скорости. Много от реакциите са бавни, защото повечето от произведените сблъсъци не са ефективни.
Основни аспекти
За да бъдат сблъсъците възможно най-ефективни, трябва да има сблъсъци, известни като ефективни сблъсъци.
Какви са ефективните хокеи ?
Има ли шокове, които генерират продукти поради реакция. Тези сблъсъци се генерират, ако са изпълнени два важни аспекта.
На първо място, за да е адекватно взаимодействието, посоката между сблъскващите се молекули трябва да бъде правилна.
Второ, трябва да има достатъчна минимална енергия (енергия на активиране) между реактивните видове по време на сблъсъка.
Тази енергия ще разруши съществуващите връзки и ще образува нови, тъй като всички реакции изискват енергиен принос за образуването на продукти.
Каква е енергията на активиране?
Според шведския учен Сванте Аррениус енергията на активиране е количеството енергия, което надвишава средното енергийно ниво, което реактивите трябва да имат, за да се развие реакцията и да се постигнат продуктите.
Теорията на сблъсъците и скоростта на реакцията
Теорията на сблъсъците е пряко свързана с химичната кинетика на реакциите.
Скоростта на реакцията се изразява като «-r» и е свързана с бързината, с която всеки реагент се трансформира за единица време и обем.
Отрицателният знак (-) се дължи на консумацията на реагента. С други думи, скоростта, с която се използва реагентът, за да образува продуктите.
За необратима реакция, където всички реагенти се превръщат в продукт, уравнението на скоростта на реакцията ще бъде както следва: -r = k * C ^ a
В тази формула "k" е специфичната скоростна константа на реакцията и е независима. От своя страна, «C» е концентрацията на реагентите.
Колкото по-висока е концентрацията, толкова по-голям е сблъсъкът и колкото по-висока е скоростта на реакцията.
Специфична скоростна константа на реакцията (k)
Формулата, съответстваща на тази константа, е k = A * e ^ (E / R * T)
"A" е честотният фактор и има същите единици като "k". "E" е енергията на активиране, необходима за сблъсъка, "R" е универсалната константа на газовете и "T" е работната температура.