Примерите за 10-те най-подходящи не-полярни ковалентни връзки
Примери за неполярни ковалентни връзки включват въглероден диоксид, етан и водород. Ковалентните връзки са вид връзка, която се образува между атомите, като запълват последния си валентен слой и образуват силно стабилни връзки.
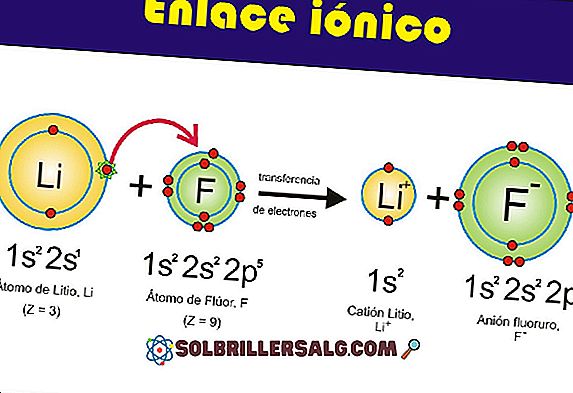
В една ковалентна връзка е необходимо електронегативността между природата на атомите да не е много голяма, тъй като ако това се случи, ще се образува йонна връзка.

Поради това, ковалентни връзки възникват между атоми с неметална природа, тъй като метал с неметал ще има забележително голяма електрическа разлика и ще бъде дадена йонна връзка.
Видове ковалентни връзки
Казано е, че е необходимо да няма значителна електроотрицателност между един атом и друг, но има атоми, които представляват лек заряд и които променят начина на разпределяне на връзките.
Ковалентните връзки могат да бъдат разделени на два типа: полярни и неполярни.
руното
Полярните връзки се отнасят до тези молекули, чийто заряд е разпределен в два полюса, положителен и отрицателен.
Не е полярна
Неполярните връзки са тези, в които техните молекули се разпределят по същия начин; два равни атома са свързани, със същата електронегативност. Това означава, че диелектричният момент е равен на нула.
10-те примера на неполярни ковалентни връзки
1 - Етан
Най-общо, простите връзки на въглеводороди са най-добрият пример за представяне на неполярни ковалентни връзки.
Неговата структура се формира от два въглеродни атома с три водорода, придружени във всяка една.
Въглеродът има ковалентна връзка с другия въглерод. Поради липсата на електроотрицателност между тях се получава неполярна връзка.
2 - Въглероден диоксид
Въглеродният диоксид (CO2) е един от най-разпространените газове на Земята поради човешкото производство.
Това е структурно оформено с един въглероден атом в средата и два кислородни атома от двете страни; всеки един прави двойна връзка с въглеродния атом.
Разпределението на таксите и теглата е същото, така че се образува линеен масив и моментът на зареждане е равен на нула.
3- Водород
Водородът в неговата газова форма се намира в природата като връзка между два водородни атома.
Водородът е изключение от правилото за октет поради неговата атомна маса, която е най-ниска. Връзката се оформя само във вид: HH.
4. Етилен
Етилен е въглеводород, подобен на етан, но вместо да има три водорода, прикрепени към всеки въглерод, той има два.
За да се образуват валентните електрони, се образува двойна връзка между всеки въглерод. Етиленът има различни промишлени приложения, главно в автомобилния сектор.
5-толуен
Толуенът се състои от ароматен пръстен и СНЗ верига.
Въпреки че пръстенът представлява много голяма маса по отношение на CH3 веригата, не-полярна ковалентна връзка се образува от липсата на електронегативност.
6 - Въглероден тетрахлорид
Въглеродният тетрахлорид (CCl4) е молекула с един въглероден атом в центъра и четири хлорни атома във всяка посока на пространството.
Въпреки че хлорът е силно негативно съединение, наличието във всички посоки прави диполния момент равен на нула, така че е неполярно съединение.
7- Изобутан
Изобутанът е въглеводород, който е силно разклонен, но чрез електронната конфигурация в въглеродните връзки присъства неполярна връзка.
8- Хексан
Хексанът е геометрично подреждане във формата на шестоъгълник. Той има въглеродни и водородни връзки и неговият диполен момент е нула.
9-Циклопентан
Подобно на хексана, той е геометрична подредба във формата на петоъгълник, тя е затворена и диполният му момент е равна на нула.
10. Азот
Азотът е едно от най-разпространените съединения в атмосферата, с около 70% състав във въздуха.
Той е представен под формата на азотна молекула с еднаква молекула, образувайки ковалентна връзка, която при същия заряд се оказва неполярна.